![]()
Теория "углеазотных комплексов" Данилевского
Разработка методов синтеза аминокислот

Глава 2. История исследования белка
2.5. Разработка методов синтеза аминокислот
Для
того чтобы перейти к синтезу производных аминокислот, соединенных
пептидной связью, Эмиль
Фишер
провел большую работу по изучению строения и синтезу аминокислот.
До Фишера общим методом синтеза аминокислот был циангидринный
синтез Адольфа
Штреккера:
![]()
По
реакции Штреккера удалось синтезировать аланин, серин и некоторые
другие аминокислоты, а по ее модификации (реакции Зелинского-Стадникова)
как ![]() -аминокислоты,
так и их N-замещенные.
-аминокислоты,
так и их N-замещенные.
Однако сам Фишер стремился разработать методы синтеза всех известных тогда аминокислот. Он считал метод Штреккера недостаточно универсальным. Поэтому Э. Фишеру пришлось искать общий метод синтеза аминокислот в том числе аминокислот со сложными боковыми радикалами.
Он
предложил аминировать бромзамещенные в ![]() -положении
карбоновые кислоты. Для получения бромопроизводных он использовал,
как например, в синтезе лейцина, арилированную или алкилированную
малоновую кислоту:
-положении
карбоновые кислоты. Для получения бромопроизводных он использовал,
как например, в синтезе лейцина, арилированную или алкилированную
малоновую кислоту:
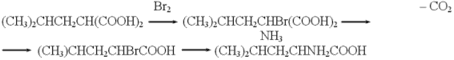
Но создать абсолютно универсальный метод Э. Фишеру не удалось. Были разработаны и более надежные реакции. Например, ученик Фишера Г. Лейкс предложил следующую модификацию для получения серина:
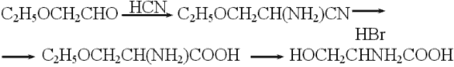
Фишер также доказал, что белки состоят из остатков оптически активных аминокислот. Это заставило его разработать новую номенклатуру оптически активных соединений, методы разделения и синтеза оптических изомеров аминокислот. Фишер также пришел к выводу, что в белках содержатся остатки L-форм оптически активных аминокислот, и он доказал это, впервые использовав принцип диастереоизомерии. Этот принцип заключался в следующем: к N-ацилпроизводному рацемической аминокислоты добавляли оптически активный алкалоид (бруцин, стрихнин, цинхонин, хинидин, хинин). В результате этого образовывались две стереоизомерные формы солей, обладающие различной растворимостью. После разделения этих диастереоизомеров алкалоид регенерировали и ацильную группу удаляли путем гидролиза.
Фишер сумел разработать метод полного определения аминокислот в продуктах гидролиза белков: он переводил хлоргидраты эфиров аминокислот обработкой концентрированной щелочью на холоду в свободные эфиры, которые заметно не омылялись. Затем смесь этих эфиров подвергал фракционной перегонке и из полученных фракций выделял отдельные аминокислоты путем дробной кристаллизации.
Новый метод анализа не только окончательно подтвердил, что белки состоят из аминокислотных остатков, но позволил уточнить и пополнить список встречающихся в белках аминокислот. Но все же количественные анализы не могли дать ответа на основной вопрос: каковы принципы строения молекулы белка. И Э.Фишер сформулировал одну из основных задач в изучении строения и свойств белка: разработка экспериментальные методы синтеза соединений, основными компонентами которых были бы аминокислоты, соединенные пептидной связью.
Таким образом Фишер поставил нетривиальную задачу - синтезировать новый класс соединений с целью установления принципов их строения.
Задачу эту Фишер решил, и химики получили убедительные доказательства, что белки представляют собой полимеры аминокислот, соединенных пептидной связью:
![]()
Это положение подтверждалось биохимическими доказательствами. Попутно выяснилось, что протеазы гидролизуют не все связи между аминокислотами с одинаковой скоростью. На их способность расщеплять пептидную связь влияли оптическая конфигурация аминокислот, заместители по азоту аминогруппы, длина цепи пептида, а также набор входящих в него остатков.
Главным доказательством пептидной теории стал синтез модельных пептидов и сопоставление их с пептонами гидролизата белков. Результаты показали, что из белковых гидролизатов выделяются пептиды, идентичные синтезированным.
В
процессе выполнения этих исследований Э.Фишер и его ученик Эмиль
Абдергальден впервые
разработали метод определения аминокислотной последовательности
в белка. Сущность его заключалась в установлении природы аминокислотного
остатка полипептида, имеющего свободную аминогруппу (N-концевую
аминокислоту). Для этого они предложили блокировать в пептиде
аминоконец ![]() -нафталин-сулфониловой
группой, которая не отщепляется при гидролизе. Выделяя затем из
гидролизата аминокислоту, меченую такой группой, можно было определить,
какая из аминокислот была N-концевой.
-нафталин-сулфониловой
группой, которая не отщепляется при гидролизе. Выделяя затем из
гидролизата аминокислоту, меченую такой группой, можно было определить,
какая из аминокислот была N-концевой.
После исследований Э.Фишера стало ясно, что белки представляют собой полипептиды. Это было важное достижение, в том числе и для задач синтеза белков: стало ясно, что именно нужно синтезировать. Только после этих работ проблема синтеза белка приобрела определенную направленность и необходимую строгость.
Говоря о работе Фишера в целом, следует отметить, что сам подход к исследованию был типичен скорее для наступающего XX века - он оперировал широким набором теоретических положений и методических приемов; его синтезы все менее и менее походили на искусство, основанное на интуиции, чем на точном знании, и приближались к созданию серий точных, почти технологических приемов.
