![]()
Традиционные методы выделения и очистки белков
Определение первичной структуры белков

Глава 7. Методы исследования белков
7.3. Определение первичной структуры белков
Определение первичной структуры белков сводится к выяснению порядка расположения аминокислот в полипептидной цепочке. Эту задачу решают с помощью метода секвенирования (от англ. sequence последовательность).
Собственно секвенирование на его сегодняшнем уровне позволяет определить аминокислотную последовательность а полипептидах, размер которых не превышает несколько десятков аминокислотных остатков. В то же время исследуемые полипептидные фрагменты значительно короче тех природных белков, с которыми приходится иметь дело. Поэтому необходимо предварительное разрезание исходного полипептида на короткие фрагменты. После секвенирования полученных фрагментов их необходимо снова сшить в первоначальной последовательности.
Таким
образом определение первичной последовательности
белка сводится к следующим основным этапам:
1) Расщепление белка на несколько фрагментов длиной,
доступной для секвенирования.
2) Секвенирование каждого из полученных фрагментов.
3) Сборка полной структуры белка из установленных
структур его фрагментов.
Для специфического расщепления белков по определенным точкам применяются как ферментативные, так и химические методы. Из ферментов, катализирующих гидролиз белков по определенным точкам, наиболее широко используют трипсин и химотрипсин. Трипсин катализирует гидролиз пептидных связей, расположенных после остатков лизина и аргинина. Химотрипсин преимущественно расщепляет белки после остатков ароматических аминокислот - фенилаланина, тирозина и триптофана. При необходимости специфичность трипсина может быть повышена или изменена. Например, обработка цитраконовым ангидридом исследуемого белка приводит к ацилированию остатков лизина. В таком модифицированном белке расщепление будет проходить только по остаткам аргинина.
Наряду с ферментативными методами используются и химические методы расщепления белков. Для этой цели часто применяют бромциан, расщепляющий белок по остаткам метионина:
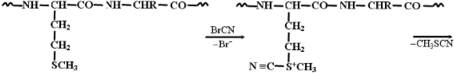
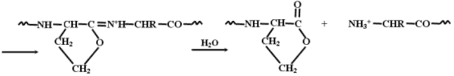
Секвенирование
проводят методом, известным как метод Эдмана.
Последовательная обработка полипептида, имеющего
свободную концевую ![]() -аминогруппу,
каким-либо алкил- или арилизотиоцианатом в слабощелочной
среде приводит к образованию соответствующей тиомочевины,
которая в умеренно кислой среде приводит (при
значениях кислотности, не повреждающих пептидной
связи) отщепляется в виде соответствующего тиогидантоина.
Оригинальная процедура Эдмана основана на использовании
фенилизотиоцианата и тем самым на образовании
фенилтиогидантоинов:
-аминогруппу,
каким-либо алкил- или арилизотиоцианатом в слабощелочной
среде приводит к образованию соответствующей тиомочевины,
которая в умеренно кислой среде приводит (при
значениях кислотности, не повреждающих пептидной
связи) отщепляется в виде соответствующего тиогидантоина.
Оригинальная процедура Эдмана основана на использовании
фенилизотиоцианата и тем самым на образовании
фенилтиогидантоинов:
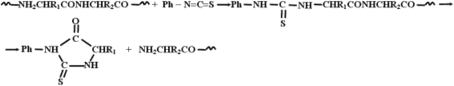
В результате образуется фенилтиогидантоин, содержащий боковой радикал аминокислоты R1, который может быть идентифицирован путем измерения какой-либо физической или физико-химической характеристики, позволяющей различать гидантоины, соответствующие разным входящим в состав белков аминокислотам. В качестве такой характеристики может служить хроматографическая подвижность в какой-либо предварительно проградуированной по стандартным образцам гидантоинов системе или молекулярная масса, определяемая с помощью масс-спектрометра.
Превращение N-концевого аминокислотного остатка в тиогидантоин приводит к укорочению анализируемой полипептидной цепи на одно звено. Выделив этот пептид, исследователь получает возможность повторить всю процедуру, установить природу второго аминокислотного остатка и выделить полипептид, укороченный на два звена. Многократное повторение такой ступенчатой деградации дает возможность последовательно идентифицировать все составляющие исходный полипептид остатки аминокислот, т.е. установить его первичную структуру. Практически метод Эдмана позволяет сделать один-два десятка шагов. Работа сводится к многократному повторению одних и тех же чередующихся процедур: добавления изотиоцианата, отщепления тиогидантоина, отделения его от укороченного пептида для последующей идентификации, выделение оставшегося полипептида в виде пригодном для следующего шага обработки. Чтобы избавить исследователей от такой монотонной работы, требующей вместе с тем строгого соблюдения условий эксперимента на каждом шаге, созданы специальные автоматизированные установки для проведения всех перечисленных операций - автоматические секвенаторы полипептидов. С их помощью удается произвести до 40-60 шагов ступенчатой деградации.
Завершающим этапом установления первичной структуры белка является восстановление порядка, в котором просеквенированные фрагменты располагались в исходном полипептиде. Чаще всего для этой цели используют подход изветный как метод перекрывающихся белков. Ниже излагается основная идея метода.
Если установлена структура всех полипептидов, полученных расщеплением исследуемого белка с помощью трипсина (далее такие полипептиды обозначаются буквой Т от слова "трипсиновые"), то остается определить для каждого из этих пептидов, с какими двумя Т-пептидами он соседствует с N- и С-конца. В структуре просеквенированных Т-пептидов такая информация полностью отсутствует. Однако ее можно частично, а в ряде случаев и полностью восстановить, если располагать аналогичными данными для серии полипептидов, полученных расщеплением того же исследуемого белка по какой-либо другой группе аминокислотных остатков. Для определенности ниже речь будет идти о полипептидах, полученных расщеплением химотрипсином (пептиды группы С, chymotryptic).
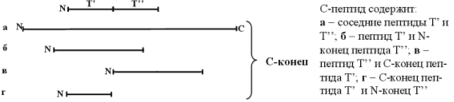
Как видно из рисунка, если два Т-пептида являются соседними в исходной цепи, то существует С-пептид, который либо содержит в своем составе полностью оба или один из рассматриваемых Т-пептидов, либо как минимум содержит С-концевую часть левого и N-концевую часть правого пептида группы Т. этот С-пептид перекрывает два соседних Т-пептида, с чем и связано название метода.
Таким образом, просматривая структуры пептидов Т и С, можно для любой пары Т-пептидов выявить, являются ли они соседями в исследуемом белке или разделены одним или несколькими другими Т-пептидами. Неоднозначность может появиться только в том случае, если перекрываемый каким-либо из С-петидов концевой фрагмент встречается у двух или нескольких Т-пептидов. Вероятность этого как правило невелика. Если это все же происходит, то применяют более сложные методы комбинаторики.
