![]()

Глава 8. Химический синтез полипептидов и белков
Химический синтез полипептидов и белков имеет большое практическое и теоретическое значение. В практическом отношении важны белковые гормоны - инсулин и вазопрессин, в настоящее время получаемые синтетическим путем. Интересны и имеют практическое применение пептиды группы пептидов мозга: метионин-энкефалин (Tyr Gly Gly Phe Met) и лейцин-энкефалин (Tyr Gly Gly Phe Leu). Эти соединения оказывают на мозговые центры такое же действие, как и морфин. Таким образом они могут применяться в качестве анальгетика, однако они практически не вызывают привыкания.
Традиционные методы синтеза регулярных полимеров позволяют получить сополимеры, состоящие из двух (или более) сходных типов мономеров со статистическим распределением их по цепи, в том числе белков. В частности, возможно получение гомополимеров или статистических сополимеров, состоящих из аминокислотных остатков, связанных пептидными связями (полиаминокислот).
В качестве примера можно привести процесс получения полиаминокислот, основанный на конденсации N-карбоксиангидридов аминокислот, образуемых из соответствующих аминокислот обработкой фосгеном:
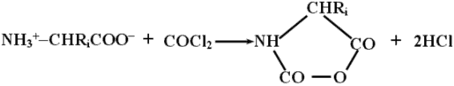
Эти соединения содержат электрофильную ангидридную группу, которая может атаковать алифатическую аминогруппу аминокислоты, используемой в качестве затравки, с выделением СО2 и одновременном освобождением новой аминогруппы из атакующей молекулы N-карбоксиангидрида, таким образом открывая возможность поликонденсации:
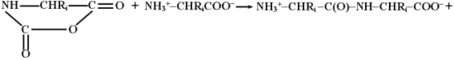
Нетрудно заметить, что каждая стадия поликонденсации (с учетом реакции образования N-карбоксиангидридов аминокислот) сопровождается превращением молекулы COCl2 в CO2 и 2HCl, что термодинамически выгодно и является источником свободной энергии для образования пептидной связи.
При
синтезе нерегулярных полипептидов базируются также
на активации карбоксильных групп. Большинство
из них базируется на использовании N,N-дициклогексилкарбодиимида
(ДЦК). Он способен в присутствии ![]() и амина
и амина ![]() осуществить активацию карбоксильных групп:
осуществить активацию карбоксильных групп:
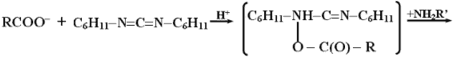
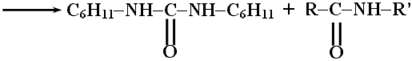
Промежуточным соединением является O-ацил-N,N'-дициклогексилмочевину (ДЦМ):
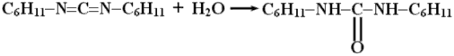
Обычно ДЦК в пептидном синтезе используется не непосредственно, а для синтеза стабильных реакционноспособных производных аминокислот, ангидридов или активированных эфиров путем реакции с соответствующими гидроксисоединениями:
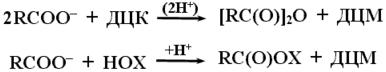
Вследствие нуклеофильного характера, должны содержать сильный электронный акцептор Х.
Тем не менее эти соединения нельзя непосредственно использовать для синтеза пептидов определенной структуры. Смешивая две аминокислоты с активированными карбоксильными группами, можно получить четыре разных дипептида:
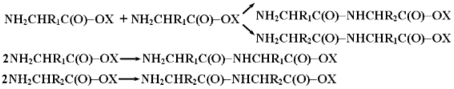
Более того из-за наличия активных групп процесс может идти дальше. Но в результате получается только статистический полимер.
Для
предотвращения образования лишних полипептидов
необходимо исключить участие в процессе аминогруппы
первой аминокислоты и активированной аминогруппы
второй (в результате получается пептид ![]() ).
Это достигается использованием защитных групп
Z на тех функциональных группах, которые не должны
вступать во взаимодействие. Реакция
).
Это достигается использованием защитных групп
Z на тех функциональных группах, которые не должны
вступать во взаимодействие. Реакция
![]()
должна
приводить к одному определенному дипипептиду.
Этот пептид
нереакционноспособен и для продолжения процесса
необходимо удалить одну из защитных групп Z1,Z2,
для того чтобы открыть либо NH2,
либо СООН- группу для следующей стадии удлинения
пептидной цепи. Поэтому главным требованием к
защитным группам является возможность их мягкого
селективного удаления, не повреждающего пептидную
связь. Наиболее широко для защиты ![]() -аминогрупп
используется трет-бутилоксикарбонильная
группа (Вос), которую легко ввести в аминогруппу
обработкой аминокислоты соответствующим N-гидроксисукциниимидным
эфиром:
-аминогрупп
используется трет-бутилоксикарбонильная
группа (Вос), которую легко ввести в аминогруппу
обработкой аминокислоты соответствующим N-гидроксисукциниимидным
эфиром:
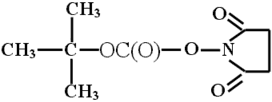
Эту группу легко удалить слабой кислотной обработкой пептида, при которой эта связь не разрушается:
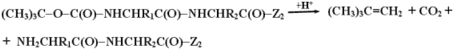
В качестве группы Z2 используют эфирные группы, которые стабильны в кислой среде в условиях проведения синтеза и могут быть селективно удалены мягкой щелочной обработкой.
Специфической особенностью полипептидного синтеза является огромное число идентичных стадий, которые необходимо проводить на каждом этапе: образование новой пептидной связи, удаление защитной группы для подготовки к следующей стадии элонгации (удлинения) цепи и промежуточные отмывки от избытка реагентов и побочных продуктов после каждого химического превращения. метод, разработанный Р.Меррифилдом, дал возможность автоматизировать этот процесс и снизить механические потери. Согласно этому методу, первый мономер во вновь строящейся цепи синтезируемого полипептида ковалентно связывается с нерастворимым носителем (смолой сополимер стиролдивинилбензола) и все последующие стадии проводятся с полипептидом, растущим на этой смоле. Этот метод известен как твердофазный синтез полипептидов. К смоле попеременно добавляют очередной синтон (мономер, содержащий набор защитных групп и в ряде случаев активированные остатки) и реагент для удаления концевой защитной группы (обычно в остаток). Химические стадии сопровождаются соответствующими промывками. В течение всего процесса пептид остается связанным со смолой. Поместив в колонку смолу, с которой связан синтезируемый полипептид, можно легко автоматизировать процесс, запрограммировав смену потоков через колонку: синтон (мономер) растворитель смесь для удаления защиты растворитель и т.д. разработаны специальные приборы для автоматизированного полипептидного синтеза. Применение такого прибора позволяет получить такие сложные полипептиды, как 99-членный полипептид протеазу, кодированную ВИЧ-1. Эта протеаза нужна для протеолитического разрезания больших полипептидов, образовавшихся при трансляции (белковом синтезе) вирусных и-РНК. Огромный интерес к этой протеазе обусловлен надеждой найти специфические ингибиторы замедляющие работу этого фермента и следовательно предотвратить образование вирусных частиц. Для синтеза приведенной выше протеазы на автоматическом пептидном синтезаторе "Applied Biosystem" потребовалось около 200 химических процедур, не считая промывок, предшествующих каждой смене реагента. На завершающей стадии защищенный полипептид, ковалентно связанный со смолой, снимается с нее и защитные группы удаляются соответствующими обработками.
